-
![[image]](https://www.balancer.ru/cache/sites/w/w/www.jamesyawn.com/titanium/2-29-04/128x128-crop/mold.jpg)
Твердые ракетные топлива карамельного типа ХII
Теги:
Pashok> В данном случае причина высокой скорости горения может быть в каркасном катализе на твердой развитой поверхности образующегося при разложении оксида кальция.
Разумно. Я тоже заметил этот странный эффект. При маленькой скорости горения образуется столбик белой окиси кальция, при быстрой все улетает. Но, при вспышке на поверхности остается тонкий слой окиси. Видимо это связано с низкой летучестью окиси, супротив щелочных. Насчет теплоизоляции тоже интересно. В будущем думаю можно будет проэкспериментировать с нитратами лития и магния, может быть цинка.
С нитратом магния правда не все так просто.
Нитрат цинка по своему интересен, его Т пл 110С ! Как раз для сорбита.
Разумно. Я тоже заметил этот странный эффект. При маленькой скорости горения образуется столбик белой окиси кальция, при быстрой все улетает. Но, при вспышке на поверхности остается тонкий слой окиси. Видимо это связано с низкой летучестью окиси, супротив щелочных. Насчет теплоизоляции тоже интересно. В будущем думаю можно будет проэкспериментировать с нитратами лития и магния, может быть цинка.
С нитратом магния правда не все так просто.
выше 90 °C обезвоживается до дигидрата, затем происходит отщепление воды с частичным гидролизом и разложение до MgO.
Нитрат цинка по своему интересен, его Т пл 110С ! Как раз для сорбита.

Pashok> А так ничего сложного на глаз и нет. У меня торцевик на кальциевке отработал 15сек нормально, с тягой. еще давно было.
...
Pashok> У кальциевой карамели кстати есть одно весьма интересное свойство на мой взгляд делающее ее очень интересным топливом именно для торцевиков ...
Большое спасибо, очень интересная информация.
...
Pashok> У кальциевой карамели кстати есть одно весьма интересное свойство на мой взгляд делающее ее очень интересным топливом именно для торцевиков ...
Большое спасибо, очень интересная информация.
Serge77> С нитратом магния я работал, топливо не получается. Разложение с выделением окиси азота начинается раньше, чем улетает вся вода. Правда и с остатками воды горело, но слабо.
Интересно! Значит это правда, что он все таки сволочь гидролизуется.
>> Нитрат цинка по своему интересен, его Т пл 110С
Serge77> Это у безводного?
Как ни странно, да.
Интересно! Значит это правда, что он все таки сволочь гидролизуется.
>> Нитрат цинка по своему интересен, его Т пл 110С
Serge77> Это у безводного?
Как ни странно, да.
110 °C (anhydrous)
45.5 °C (trihydrate)
36.4 °C (hexahydrate)

Serge77> 110 °C (anhydrous)
Serge77> Интересно. Только неясно, можно ли его получить просто нагреванием гидрата.
Видимо да.
Serge77> В любом случае цинк тяжёлый, нет выигрыша в УИ по сравнению с калием.
Конечно. По сколько он двухвалентный, то получается не тяжелее нитрата калия.
Формально нитрат цинка на одну валетность имеет массу 32,7. Меньше чем у калия - 39.
Serge77> Интересно. Только неясно, можно ли его получить просто нагреванием гидрата.
Видимо да.
Serge77> В любом случае цинк тяжёлый, нет выигрыша в УИ по сравнению с калием.
Конечно. По сколько он двухвалентный, то получается не тяжелее нитрата калия.
Формально нитрат цинка на одну валетность имеет массу 32,7. Меньше чем у калия - 39.

Serge77>> Только неясно, можно ли его получить просто нагреванием гидрата.
Ясно. Нельзя.
Zinc Nitrate.-The anhydrous salt cannot be prepared from the hydrate, since removal of
water of crystallisation leads to decomposition of the nitrate, and the formation of basic salts
(Marketos, Compt. rend., 1912, 155, 210; Dubsky and Nevralova, Chem. Listy, 1931, 25, 373).
Marketos (ZOC. cit.) prepared the anhydrous nitrate by heating the tri- and tetra-hydrate at
130-135” in a current of carbon dioxide and dinitrogen pentoxide; a pasty substance was
obtained which crystallised on cooling, and commenced to decompose at temperatures slightly
above 135”. Ewing, Bradner, and Guyer (J. Amer. Chem. Soc., 1939, 61, 260) found that ‘ I the
preparation of anhydrous zinc nitrate offered extreme difficulties.” They prepared the material
by reaction of gaseous dinitrogen pentoxide with zinc oxide, using ozone to inhibit the slow
decomposition of the dinitrogen pentoxide.
Addison, Lewis, and Thomfison. 628. The Liquid Dinitrogen Tetroxide Solvent System. Part VIL* Products of Reaction of Zinc with
ajet> Формально нитрат цинка на одну валетность имеет массу 32,7. Меньше чем у калия - 39.
Я в курсе))
Ясно. Нельзя.
Zinc Nitrate.-The anhydrous salt cannot be prepared from the hydrate, since removal of
water of crystallisation leads to decomposition of the nitrate, and the formation of basic salts
(Marketos, Compt. rend., 1912, 155, 210; Dubsky and Nevralova, Chem. Listy, 1931, 25, 373).
Marketos (ZOC. cit.) prepared the anhydrous nitrate by heating the tri- and tetra-hydrate at
130-135” in a current of carbon dioxide and dinitrogen pentoxide; a pasty substance was
obtained which crystallised on cooling, and commenced to decompose at temperatures slightly
above 135”. Ewing, Bradner, and Guyer (J. Amer. Chem. Soc., 1939, 61, 260) found that ‘ I the
preparation of anhydrous zinc nitrate offered extreme difficulties.” They prepared the material
by reaction of gaseous dinitrogen pentoxide with zinc oxide, using ozone to inhibit the slow
decomposition of the dinitrogen pentoxide.
Addison, Lewis, and Thomfison. 628. The Liquid Dinitrogen Tetroxide Solvent System. Part VIL* Products of Reaction of Zinc with
ajet> Формально нитрат цинка на одну валетность имеет массу 32,7. Меньше чем у калия - 39.
Я в курсе))

ajet> Кстати вопрос, а никто не пробовал добавлять в карамель в качестве катализатора оксид меди, CuO ?
ajet> Здесь только комментарий:
ajet> Любительское ракетостроение
Я, как-то, заехал на один небольшой заводик, который занимается тем, что плавит списанные, медные аноды, льет и тянет медные провода, покрывает изоляцией...зашел в горячий цех, там, где жидкий металл на моих глазах превратился в провод, толщиной где-то около 12 мм. После того, как он остыл, с него снимается окалина - окись меди.
Взяв себе, на пробу,(как, говорится, из первоисточника) я без труда добавил ее в стандартное сорбитовое топливо в размере 5% при 120 градусах и зарядил проверенный, со скрепленной шашкой, двигатель.После установки на ракету, двигатель отработал хорошо, доставив удовольствие.
Ну, разве что, кроме розового дыма, от восстанавливаемой меди, такого же цвета стал стартовый стол...впрочем, отмылся хорошо.
Кажется, положительного мнения об окиси меди не только я:

Проверяйте.Пробуйте.Соблюдайте, как всегда, осторожность.
ajet> Здесь только комментарий:
ajet> Любительское ракетостроение
Я, как-то, заехал на один небольшой заводик, который занимается тем, что плавит списанные, медные аноды, льет и тянет медные провода, покрывает изоляцией...зашел в горячий цех, там, где жидкий металл на моих глазах превратился в провод, толщиной где-то около 12 мм. После того, как он остыл, с него снимается окалина - окись меди.
Взяв себе, на пробу,(как, говорится, из первоисточника) я без труда добавил ее в стандартное сорбитовое топливо в размере 5% при 120 градусах и зарядил проверенный, со скрепленной шашкой, двигатель.После установки на ракету, двигатель отработал хорошо, доставив удовольствие.
Ну, разве что, кроме розового дыма, от восстанавливаемой меди, такого же цвета стал стартовый стол...впрочем, отмылся хорошо.
Кажется, положительного мнения об окиси меди не только я:

Карамельное ракетное топливо — Википедия
Караме́льное то́пливо — твёрдое ракетное топливо, относящееся к смесевым топливам с органической связкой. Базовый, наиболее изученный и часто используемый состав — калия нитрата (КNО3) 65 % и сорбита 35 % по массе. Такой состав близок к оптимуму по достижимому удельному импульсу при небольших степенях расширения, характерных для модельных РДТТ. Умеренный показатель степени в законе горения делает топливо пригодным для работы в широком диапазоне давлений, и, как следствие, подходящим для кустарно изготавливаемых РДТТ с заметным разбросом геометрических характеристик. // Дальше — ru.wikipedia.orgПроверяйте.Пробуйте.Соблюдайте, как всегда, осторожность.

Laska_2879> Ну, разве что, кроме розового дыма, от восстанавливаемой меди, такого же цвета стал стартовый стол...впрочем, отмылся хорошо.
http://hddfiles.ru/download/20198/
http://hddfiles.ru/download/20198/

Laska_2879> Взяв себе, на пробу,(как, говорится, из первоисточника) я без труда добавил ее в стандартное сорбитовое топливо в размере 5% при 120 градусах и зарядил проверенный, со скрепленной шашкой, двигатель.После установки на ракету, двигатель отработал хорошо, доставив удовольствие.
1. В Википедии есть только упоминание, не более.
2. Были комментарии на форуме, что вроде толку от нее нет. У Вас нет данных по каталитической активности.
3. Вопрос безопасности превыше всего. Было сообщение, что при 130С это может вспыхнуть.
1. В Википедии есть только упоминание, не более.
2. Были комментарии на форуме, что вроде толку от нее нет. У Вас нет данных по каталитической активности.
3. Вопрос безопасности превыше всего. Было сообщение, что при 130С это может вспыхнуть.

Serge77>> Только неясно, можно ли его получить просто нагреванием гидрата.
Serge77>> Ясно. Нельзя.
ajet> Понятно. Нитраты магния и цинка для особо интересующихся
Как и медь, цинк дает комплексные соли с аммиаком -принцип получения тот же: оксид + АН. Эти комплексы (около 5%) кое-кто использует для фазовой стабилизации,а в добавок, и как катализатор разложения АН (Статья в pdf гуглилась по слову PSAN и т.д.). Там, правда, есть вопросы с остаточной влагой, влияющей на стабилизацию.
ajet> Нитрат цинка по своему интересен, его Т пл 110С ! Как раз для сорбита.
Боюсь, правда, что амммиачные комплексы цинка -это уже не карамельная тематика
Serge77>> Ясно. Нельзя.
ajet> Понятно. Нитраты магния и цинка для особо интересующихся

Как и медь, цинк дает комплексные соли с аммиаком -принцип получения тот же: оксид + АН. Эти комплексы (около 5%) кое-кто использует для фазовой стабилизации,а в добавок, и как катализатор разложения АН (Статья в pdf гуглилась по слову PSAN и т.д.). Там, правда, есть вопросы с остаточной влагой, влияющей на стабилизацию.
ajet> Нитрат цинка по своему интересен, его Т пл 110С ! Как раз для сорбита.
Боюсь, правда, что амммиачные комплексы цинка -это уже не карамельная тематика
ajet>> Кстати вопрос, а никто не пробовал добавлять в карамель в качестве катализатора оксид меди, CuO ?
Laska_2879> Я, как-то, заехал на один небольшой заводик, ...зашел в горячий цех, ... окалина - окись меди.
Laska_2879> ... добавил ее в стандартное сорбитовое топливо в размере 5% при 120 градусах и зарядил проверенный, со скрепленной шашкой, двигатель.После установки на ракету, двигатель отработал хорошо, доставив удовольствие.
Laska_2879> Кажется, положительного мнения об окиси меди не только я:
Laska_2879> Карамельное ракетное топливо — Википедия
Статью в википедии писал я и фотка эта моего производства
и фотка эта моего производства  на ней топливо покрашено оксидом железа. Так что ссылаться на вики большого смысла нет
на ней топливо покрашено оксидом железа. Так что ссылаться на вики большого смысла нет 
Помимо того, что оксид меди сильно понижает температуру вспышки, он ещё и повышает показатель степени в законе горения. Интересно, что оксид железа, наоборот, понижает, правда, очень слабо.
Laska_2879> Я, как-то, заехал на один небольшой заводик, ...зашел в горячий цех, ... окалина - окись меди.
Laska_2879> ... добавил ее в стандартное сорбитовое топливо в размере 5% при 120 градусах и зарядил проверенный, со скрепленной шашкой, двигатель.После установки на ракету, двигатель отработал хорошо, доставив удовольствие.
Laska_2879> Кажется, положительного мнения об окиси меди не только я:
Laska_2879> Карамельное ракетное топливо — Википедия
Статью в википедии писал я
 и фотка эта моего производства
и фотка эта моего производства  на ней топливо покрашено оксидом железа. Так что ссылаться на вики большого смысла нет
на ней топливо покрашено оксидом железа. Так что ссылаться на вики большого смысла нет 
Помимо того, что оксид меди сильно понижает температуру вспышки, он ещё и повышает показатель степени в законе горения. Интересно, что оксид железа, наоборот, понижает, правда, очень слабо.

А.С.>> Статью в википедии писал я
Serge77> Хорошая статья, грамотно и ровно написана.
Да, то, что там было до этого, пришлось полностью выкинуть Но я был удивлён уже тем, что такая статья появилась.
Но я был удивлён уже тем, что такая статья появилась.
Serge77> Но насчёт окиси меди лучше там поправить, на форуме были сообщения о воспламенении при плавлении топлива.
Поправил.
Serge77> Хорошая статья, грамотно и ровно написана.
Да, то, что там было до этого, пришлось полностью выкинуть
 Но я был удивлён уже тем, что такая статья появилась.
Но я был удивлён уже тем, что такая статья появилась.Serge77> Но насчёт окиси меди лучше там поправить, на форуме были сообщения о воспламенении при плавлении топлива.
Поправил.


Можно также добавить, что Fe2O3 облегчает воспламенение топлива - как сорбитового, так и сахарного. Можно упомянуть о том, что для облегчения формовки заряда в сахарное топливо можно добавлять сорбит. Добавить в скобках оригинальную транскрипцию имён и фамилий.
А.С.> Статью в википедии писал я 
Да, Вы, батенька, диверсант!
А, я тут, тоже - хорош! Ракеты запускаю! Ну и ну!
Ну и ну! 

Да, Вы, батенька, диверсант!

А, я тут, тоже - хорош! Ракеты запускаю!
 Ну и ну!
Ну и ну! 

ajet>> Здесь только комментарий:
ajet>> Любительское ракетостроение
Я пытался делать. Закончилось реакцией окиси с сорбитом, с разогревом, вспениванием и покраснением. До 120 градусов всё вроде было в порядке, даже успел скатать колбаску (она была черная, горела быстро), и зарядить маленький движок на 20 грамм.
Потом оставшиеся тридцать грамм "поднялись" как тесто, после застывания превратившись в негорючюю красную пену. Возможно реакция медленно начиналась, а потом шла с ускорением, или её спровоцировал небольшой перегрев (при том методе плавления, который пользую я, он вряд ли мог превысить 130 градусов)
Разогрев смеси был. Будь там не 30 грамм, а 150, почти уверен, что полыхнуло бы.
Я бы не делал вообще.
ajet>> Любительское ракетостроение
Я пытался делать. Закончилось реакцией окиси с сорбитом, с разогревом, вспениванием и покраснением. До 120 градусов всё вроде было в порядке, даже успел скатать колбаску (она была черная, горела быстро), и зарядить маленький движок на 20 грамм.
Потом оставшиеся тридцать грамм "поднялись" как тесто, после застывания превратившись в негорючюю красную пену. Возможно реакция медленно начиналась, а потом шла с ускорением, или её спровоцировал небольшой перегрев (при том методе плавления, который пользую я, он вряд ли мог превысить 130 градусов)
Разогрев смеси был. Будь там не 30 грамм, а 150, почти уверен, что полыхнуло бы.
Я бы не делал вообще.
IvanV> Потом оставшиеся тридцать грамм "поднялись" как тесто, после застывания превратившись в негорючюю красную пену.
Красную или коричнево-красную? в смысле, цвета меди или цвета её закиси?
IvanV> Возможно реакция медленно начиналась, а потом шла с ускорением, или её спровоцировал небольшой перегрев (при том методе плавления, который пользую я, он вряд ли мог превысить 130 градусов)
IvanV> Разогрев смеси был. Будь там не 30 грамм, а 150, почти уверен, что полыхнуло бы.
Похоже на присутствие кислоты в селитре. При нейтральной реакции такого не происходит и при 135 градусах.
IvanV> Я бы не делал вообще.
Ну я делал один раз, причём, замешивал окись меди в уже готовое старое топливо, оно легче плавится, чем исходная смесь. Уже при 95 градусах состав достаточно жидкий для равномерного размешивания 1% окиси меди. Никакой реакции не ощутил во время приготовления. Цвет остался чисто чёрным, ни зеленоватого, ни красноватого оттенка не было. Окись меди делал термическим разложением кристаллогидрата нитрата меди.
Прибавка скорости при атмосферном давлении была куда меньше, чем с оксидом железа, и я решил, что игра не стоит свеч. Окись железа я тоже делал сам, из хлорного железа и соды, и его чистота, наверно, была хуже.
В общем, с окисью меди всё очень сильно зависит от других примесей, и лучше с ней не связываться, хотя у кого-то может получиться несколько раз. До первого неудачного.
Красную или коричнево-красную? в смысле, цвета меди или цвета её закиси?
IvanV> Возможно реакция медленно начиналась, а потом шла с ускорением, или её спровоцировал небольшой перегрев (при том методе плавления, который пользую я, он вряд ли мог превысить 130 градусов)
IvanV> Разогрев смеси был. Будь там не 30 грамм, а 150, почти уверен, что полыхнуло бы.
Похоже на присутствие кислоты в селитре. При нейтральной реакции такого не происходит и при 135 градусах.
IvanV> Я бы не делал вообще.
Ну я делал один раз, причём, замешивал окись меди в уже готовое старое топливо, оно легче плавится, чем исходная смесь. Уже при 95 градусах состав достаточно жидкий для равномерного размешивания 1% окиси меди. Никакой реакции не ощутил во время приготовления. Цвет остался чисто чёрным, ни зеленоватого, ни красноватого оттенка не было. Окись меди делал термическим разложением кристаллогидрата нитрата меди.
Прибавка скорости при атмосферном давлении была куда меньше, чем с оксидом железа, и я решил, что игра не стоит свеч. Окись железа я тоже делал сам, из хлорного железа и соды, и его чистота, наверно, была хуже.
В общем, с окисью меди всё очень сильно зависит от других примесей, и лучше с ней не связываться, хотя у кого-то может получиться несколько раз. До первого неудачного.

А.С.>> Статью в википедии писал я 
Laska_2879> Да, Вы, батенька, диверсант!
Laska_2879> А, я тут, тоже - хорош! Ракеты запускаю! Ну и ну!
Ну и ну! 
А почему диверсант-то? я ж, прежде чем в вики писать, попробовал
я ж, прежде чем в вики писать, попробовал 

Laska_2879> Да, Вы, батенька, диверсант!

Laska_2879> А, я тут, тоже - хорош! Ракеты запускаю!
 Ну и ну!
Ну и ну! 
А почему диверсант-то?
 я ж, прежде чем в вики писать, попробовал
я ж, прежде чем в вики писать, попробовал 

А.С.>>> Статью в википедии писал я 
Laska_2879>> Да, Вы, батенька, диверсант!
Laska_2879>> А, я тут, тоже - хорош! Ракеты запускаю! Ну и ну!
Ну и ну! 
А.С.> А почему диверсант-то? я ж, прежде чем в вики писать, попробовал
я ж, прежде чем в вики писать, попробовал 
Диверсант-диверсант...мирового масштаба. Ты попробовал - цел остался. Я попробовал - цел остался.
Ты попробовал - цел остался. Я попробовал - цел остался.
Он попробовал -...? Вообщем и так все ясно.
Остатки буду использовать с ПХА.

Laska_2879>> Да, Вы, батенька, диверсант!

Laska_2879>> А, я тут, тоже - хорош! Ракеты запускаю!
 Ну и ну!
Ну и ну! 
А.С.> А почему диверсант-то?
 я ж, прежде чем в вики писать, попробовал
я ж, прежде чем в вики писать, попробовал 
Диверсант-диверсант...мирового масштаба.
 Ты попробовал - цел остался. Я попробовал - цел остался.
Ты попробовал - цел остался. Я попробовал - цел остался.Он попробовал -...? Вообщем и так все ясно.
Остатки буду использовать с ПХА.

Это сообщение редактировалось 06.10.2012 в 15:08
А.С.> Красную или коричнево-красную? в смысле, цвета меди или цвета её закиси?
Скорее в коричнево-красную. Честно говоря, был сильно удивлен, так как сорбит альдегидных групп не содержит)
А.С.> Похоже на присутствие кислоты в селитре. При нейтральной реакции такого не происходит и при 135 градусах.
Намекаешь на образование нитрата меди? Тогда тем более здорово, что меня пронесло.
Скорее в коричнево-красную. Честно говоря, был сильно удивлен, так как сорбит альдегидных групп не содержит)
А.С.> Похоже на присутствие кислоты в селитре. При нейтральной реакции такого не происходит и при 135 градусах.
Намекаешь на образование нитрата меди? Тогда тем более здорово, что меня пронесло.
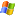
Дошли руки наконец до кальциевой карамели с ацетатом.
Исследовал состав 4,72 г нитрата кальция, 1,33 сорбита и 0.69 ацетата натрия. Делал мокрым способ в лоб, расплав получается очень вязким, под конец как густая замазка. Характер горения сильно зависит от содержания остаточной влаги. Пластилиновая карамель горит со скоростью 2 мм/с, твердая 9 мм/с. Горит очень красиво, быстро и ровно, с легким шипением. Но заметил, что при кустарном нагревании смесь легко загорается при перегреве. При высоком содержании влаги горение идет с образованием шлака, при ее удалении шлак не образуется.
Воду может стоит удалять по вакуумом. Но в принципе сам процесс изготовления не понравился, видимо нужно использовать рецепт от Pashok.
Исследовал состав 4,72 г нитрата кальция, 1,33 сорбита и 0.69 ацетата натрия. Делал мокрым способ в лоб, расплав получается очень вязким, под конец как густая замазка. Характер горения сильно зависит от содержания остаточной влаги. Пластилиновая карамель горит со скоростью 2 мм/с, твердая 9 мм/с. Горит очень красиво, быстро и ровно, с легким шипением. Но заметил, что при кустарном нагревании смесь легко загорается при перегреве. При высоком содержании влаги горение идет с образованием шлака, при ее удалении шлак не образуется.
Воду может стоит удалять по вакуумом. Но в принципе сам процесс изготовления не понравился, видимо нужно использовать рецепт от Pashok.

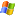
Это сообщение редактировалось 07.10.2012 в 16:45
Для очистки совести сделал два эксперимента с ацетатом натрия + нитраты.
1. 80% нитрата калия и 20% ацетата натрия совершенно безобидны. При самом лютом перегреве отчайно НЕ горит.
2. 70% нитрата кальция 30% ацетата натрия мокрым методом + сушка + измельчение дают "белый порох". Горит превосходно, вспышкой, запах не щелочной, как при горении черного пороха и карамели. При плавлении получается расплав, но из него трудно сделать шашечки (а перегревать я не решился). Твердый расплав горит очень быстро. Сам порошок и твердые агломераты не гигроскопичны.
1. 80% нитрата калия и 20% ацетата натрия совершенно безобидны. При самом лютом перегреве отчайно НЕ горит.
2. 70% нитрата кальция 30% ацетата натрия мокрым методом + сушка + измельчение дают "белый порох". Горит превосходно, вспышкой, запах не щелочной, как при горении черного пороха и карамели. При плавлении получается расплав, но из него трудно сделать шашечки (а перегревать я не решился). Твердый расплав горит очень быстро. Сам порошок и твердые агломераты не гигроскопичны.

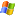
Это сообщение редактировалось 07.10.2012 в 16:33
Copyright © Balancer 1997..2022
Создано 10.11.2008
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
Создано 10.11.2008
Связь с владельцами и администрацией сайта: anonisimov@gmail.com, rwasp1957@yandex.ru и admin@balancer.ru.
 ajet
ajet
 инфо
инфо инструменты
инструменты Non-conformist
Non-conformist








